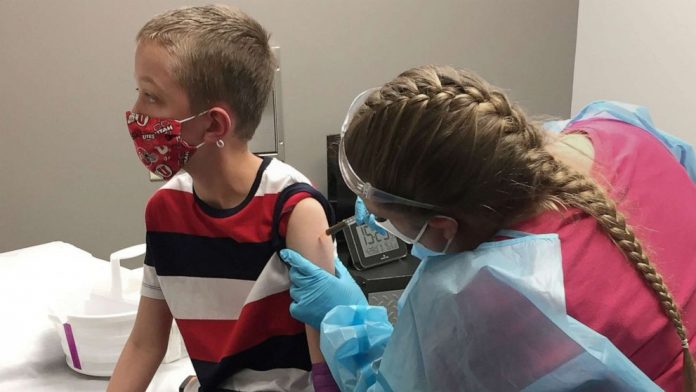
【美洲华联社9月28日洛杉矶报道】辉瑞和BioNTech周二表示,他们已向美国食品和药物管理局提交了5至11岁儿童的新冠病毒-19疫苗数据,以供初步审查,但尚未寻求紧急使用授权。
两家公司在一份声明中表示,预计未来几周将有一份正式的申请书向欧盟疫苗管理局提出申请。他们说,还计划向欧洲药品管理局(EUA)和其他监管机构提交申请。
CNN的报道称,这是首次向FDA提交针对幼儿的新冠病毒-19疫苗的数据。辉瑞/BioNTech疫苗被批准用于16岁及以上的人群,并被EUA批准用于12至15岁人群。
上周,辉瑞公司公布了一项2/3期试验的细节,该试验表明其新冠病毒-19疫苗是安全的,并在5至11岁的儿童中产生了“强劲”的抗体反应。该试验包括2268名年龄在5岁至11岁的参与者,他们使用了间隔21天注射的两剂疫苗。这项试验使用了10微克的剂量,比12岁及以上的人使用的30微克剂量要小。
参与者的免疫反应是通过观察他们血液中的中和抗体水平,并将这些水平与16至25岁的对照组进行比较来测量的,对照组接受两次剂量方案和更大的30微克剂量。辉瑞公司表示,这些水平与接受大剂量治疗的老年人相比,表现出“第二次给药一个月后,这组儿童的免疫反应强烈。”
FDA官员表示,一旦提交疫苗数据,该机构可以在几周内(而不是几个月)批准为年幼儿童接种疫苗,但这取决于所提供数据的时间和质量。
预计FDA将召集疫苗顾问,在授权前就疫苗提出建议。如果FDA同意,CDC疫苗顾问小组将开会考虑是否建议使用它。
国家过敏和传染病研究所所长·福奇博士上周告诉MSNBC说,这种疫苗“很有可能”在10月底之前上市。