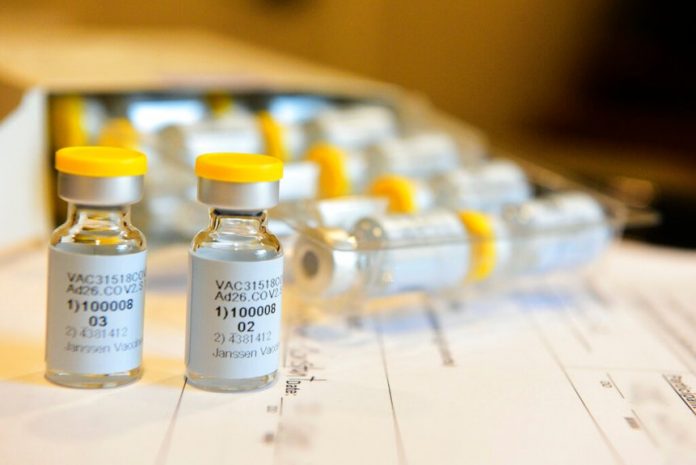
【美洲华联社洛杉矶9月23日报道】强生公司(Johnson & Johnson)正在开始一项巨大的最终研究,试图证明单剂量的COVID-19疫苗是否能够抵御病毒。
根据美联社报道,本周三开始的这项研究将是迄今为止世界上最大的冠状病毒疫苗研究之一,将在美国、南非、阿根廷、巴西、智利、哥伦比亚、墨西哥和秘鲁的6万名志愿者中进行试验。
美国的一些其他疫苗,包括现代公司(ModernaInc.)和辉瑞公司(PfizerInc.)生产的疫苗,以及其他国家的疫苗,已经进入了最后阶段的测试。人们寄予厚望的是,至少有一种在美国接受测试的疫苗可能会在年底前或许更早的时间到来。
美国卫生官员坚称,疫苗的竞争并没有走捷径。
美国国立卫生研究院院长弗朗西斯·柯林斯博士对记者说:“我们希望在不牺牲安全性和有效性的前提下尽一切努力,以确保我们最终获得能够挽救生命的疫苗。”
但许多疫苗专家质疑,在特朗普政府的巨大压力下,食品和药物管理局(FDA)是否会坚持这一目标。美国总统特朗普提出的新疫苗时间表一直比专家们所说的要快。特朗普周三在推特上发布了强生研究的新闻报道的链接,并表示FDA“必须迅速行动!”
与此同时,阿斯利康公司生产的另一种实验性疫苗的测试在美国仍处于搁置状态,因为正在研究一个安全性问题,尽管其他国家已经恢复了研究。
本周早些时候,美国副总统迈克·彭斯敦促各州州长“尽你所能,建立公众对疫苗将是一种安全有效的疫苗的信心。”
美国顶级传染病专家安东尼·福奇博士在给州长们的电话中补充说,他对“一个经过检验和真实的过程”充满信心,其中包括一个独立的委员会评估每项疫苗试验的进展,以及“FDA的诚信”。
参议员们定于周三晚些时候就疫情大流行的应对措施质询食品和药物管理局局长斯蒂芬·哈恩、福奇和其他政府官员。
即使食品和药物管理局允许在年底前紧急使用疫苗,供应也将受到限制;疫苗首先提供给弱势群体,如卫生工作者,大多数美国人不太可能在明年某个时候接种疫苗。
疾病控制和预防中心(CDC)希望各州现在就准备好进行疫苗接种,这将带来巨大的后勤挑战。周三,CDC将宣布要求国会拨款2亿美元,以帮助其开展业务。
卫生和公共服务部部长阿扎尔说,COVID-19疫苗接种活动将建立在联邦政府和各州在免疫接种方面长期合作的基础上。
仿照该公司研制的埃博拉疫苗,强生公司的疫苗是在后期测试中使用与其他疫苗稍有不同的技术。与其他三种在美国开始后期测试的疫苗不同,强生公司的疫苗只需要注射一次、而不是两次。强生首席科学官保罗·斯托弗斯博士告诉记者,尽管这项研究的开始时间比竞争对手晚,但该研究规模足够大,很可能在明年年初得出答案。