【美洲华联社12月23日洛杉矶报道】美国监管机构周四授权美国第2种抗CVID-19药物,为治疗OmiCon感染的上升趋势提供另一种易于使用的药物。
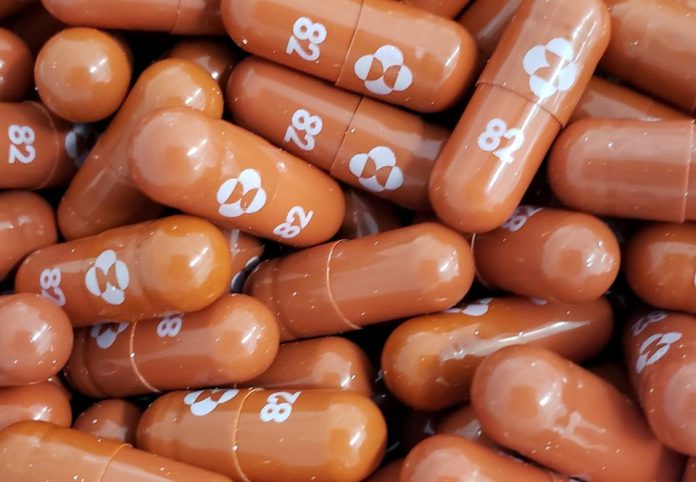
在FDA授权辉瑞公司的1天后,又授权默克公司(Merck)的Molnupiravir,让民众在对抗 CVID-19 上有了2种选择。
不过据美联社报道,辉瑞公司生产的Paxlovid药丸,由于其优越的疗效和较轻的副作用,很可能成为治疗该病毒的首选药物。
默克公司的药丸预计在对抗疫情大流行方面的作用要比几周前预测的要小;在抗击2019冠状病毒疾病的能力比最初宣布的要小很多,药物标签会警告严重的安全问题,包括潜在的出生缺陷。
这两种治疗方法在联邦政府购买后将免费提供给美国患者。
DA批准默克公司的药物用于covid-19检测呈阳性、早期症状和面临住院风险最高的成年人,包括老年人和患有肥胖和心脏病等疾病的人。
该机构表示,对于“FDA授权的covid-19替代治疗方案无法获得或临床上不合适”的患者,应该考虑 Molnupiravir 。这不包括对 Paxlovid的限制,它被授权给12岁及以上的患者。
由默克公司和Ridgeback生物疗法公司生产的 Molnupiravir 也将对不要在怀孕期间使用发出警告。FDA表示,育龄妇女应在治疗期间和治疗后的几天内使用避孕措施,而男性应在最后一次服用剂量后至少三个月内使用避孕措施。该联邦机构还表示, Molnupiravir 不应用于18岁以下的患者,因为可能会影响骨骼生长。
默克公司临床研究高级副总裁Dr. Nick Kartsonis表示,公司科学家仍在研究该药物,他们希望最终批准该药物用于儿童。他说:“事实上,这种药物看起来耐受性很好。”。
辉瑞的Paxlovid也有局限性。监管者说,医生必须考虑它会如何与患者可能服用的其他药物相互作用,他们已经注意到不应该给患有严重肝肾问题的病人开处方。
这两种治疗都应该在症状开始后的五天内开始,这是一个给患者施加压力的最后期限,要求他们尽快进行检测和诊断。
这两种药片的作用不同,辉瑞的也没有相同的风险。此外,辉瑞公司的药物在检测方面的有效性大约是默克公司的三倍,将高危患者的住院率和死亡率降低了近90%,而默克公司的这一比例为30%。
一些专家质疑默克公司的药物在美国是否会发挥很大作用。
Mayo诊所的Dr. Gregory Poland在谈到默克公司的药物时说:“鉴于辉瑞药丸的供应充足,我认为它不会被使用。”。“没有理由,因为它的疗效较低,副作用风险较高。”
就目前而言,FDA的决定提供了另一种可能的选择,以对抗已导致80多万美国人死亡的病毒,尽管卫生官员正在为创纪录的病例、住院治疗和由omicron变异引起的死亡做好准备。
美国2019冠状病毒疾病的七天滚动平均值在星期三上升到160000,约翰霍普金斯大学的数据显示。这是11月底平均水平的两倍多。
像默克和辉瑞这样的抗病毒药片有望对 omicron ,因为它们不针对大多数变异令人担忧的突变所在的刺突蛋白。研究人员警告说,对2019冠状病毒疾病的治疗不太可能对抗这种新菌株。
FDA根据默克公司的决定,结果显示近7%的服用该药的患者最终住院,其中一人在30天内死亡。相比之下,10%的住院患者服用安慰剂,9人死亡。
默克公司表示,在未来几天内,美国将提供数十万个疗程,在未来几周内将提供一百万个疗程。辉瑞制药的药物供应在2022年开始增加之前更为有限。
美国将为默克公司的每一疗程药物支付约700美元,该药物要求患者每天服用4次药物,每次2片,连续5天。哈佛大学和伦敦国王学院的一项评估估计,40片疗程的每次费用约为18美元。
美联社的报道称,默克公司的药物在冠状病毒的基因密码中插入了微小的错误,以减缓其繁殖。这种基因效应引起了人们的担忧,即该药物可能会导致人类胎儿的突变,甚至会刺激更致命的病毒毒株。但FDA的科学家表示,这种变异风险在很大程度上是理论上的,因为人们服用该药物的时间很短。